Ogni tessuto artificiale ha una data di scadenza stampata nelle sue cellule. Senza circolazione sanguigna, le strutture tridimensionali bioingegnerizate collassano: prima rallentano, poi smettono di funzionare, infine muoiono per mancanza di ossigeno. È il limite che ha fermato per anni la medicina rigenerativa. Ma i ricercatori della Binghamton University hanno sviluppato microtubi polimerici da 1-10 micron che funzionano come vasi sanguigni artificiali, distribuendo fluidi e ossigeno anche nelle zone più profonde dei tessuti ingegnerizzati. Il risultato? Cellule che sopravvivono, tessuti che funzionano, organi che potrebbero diventare realtà.
Sistema vascolare artificiale, il problema che nessuno riusciva a risolvere
Quando costruisci tessuti in laboratorio, puoi controllare quasi tutto. La forma, la densità cellulare, la composizione della matrice extracellulare. Ma c’è una cosa che non puoi forzare: il sistema vascolare. Le cellule vivono fino a quando ricevono ossigeno e nutrienti, e senza una rete di capillari che distribuisca sangue ovunque serva, anche il tessuto più perfetto sviluppa zone morte. Si chiama necrosi, ed è il motivo per cui i tessuti artificiali oltre una certa dimensione semplicemente non funzionano.
La stampa 3D riesce a creare vasi più grandi (arterie, vene principali), ma i capillari microscopici sono un’altra storia. Servono strutture che si autoassemblano, che crescono seguendo segnali chimici, che si adattano. Oppure servono microtubi ingegnerizzati abbastanza piccoli da imitare i capillari veri.
Elettrofilatura e polimeri, la ricetta per vasi microscopici
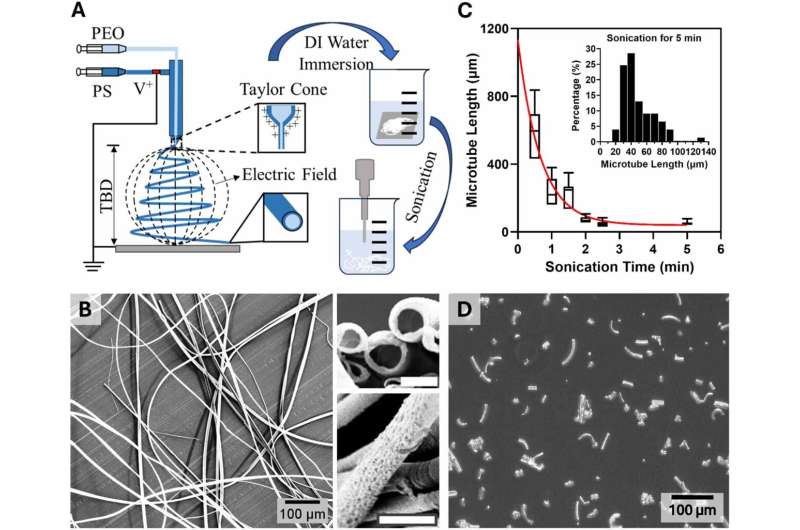
Il team guidato da Ying Wang e Yingge Zhou ha usato l’elettrofilatura, una tecnica che sfrutta campi elettrici per creare fibre ultrasottili. Prendono due polimeri inerti (polietilene ossido e polistirene), li trasformano in fibre solide tramite elettrofilatura, poi dissolvono il nucleo interno per renderle cave. Infine, usano ultrasuoni per spezzarle in segmenti più corti, così si disperdono meglio nel tessuto artificiale.
I microtubi misurano tra 1 e 10 micron di diametro. Per capirci: un capello umano è largo 70-100 micron. Sono strutture invisibili a occhio nudo, ma abbastanza grandi da permettere il passaggio di fluidi e microsfere che imitano il comportamento del sangue.
I ricercatori hanno testato i microtubi usando microsfere fluorescenti per tracciare il flusso nei tessuti ingegnerizzati. I risultati mostrano che i tubi migliorano significativamente la distribuzione del sangue, fornendo alle cellule l’ossigeno e i nutrienti necessari per restare vive. Niente più zone necrotiche, niente più collassi cellulari.
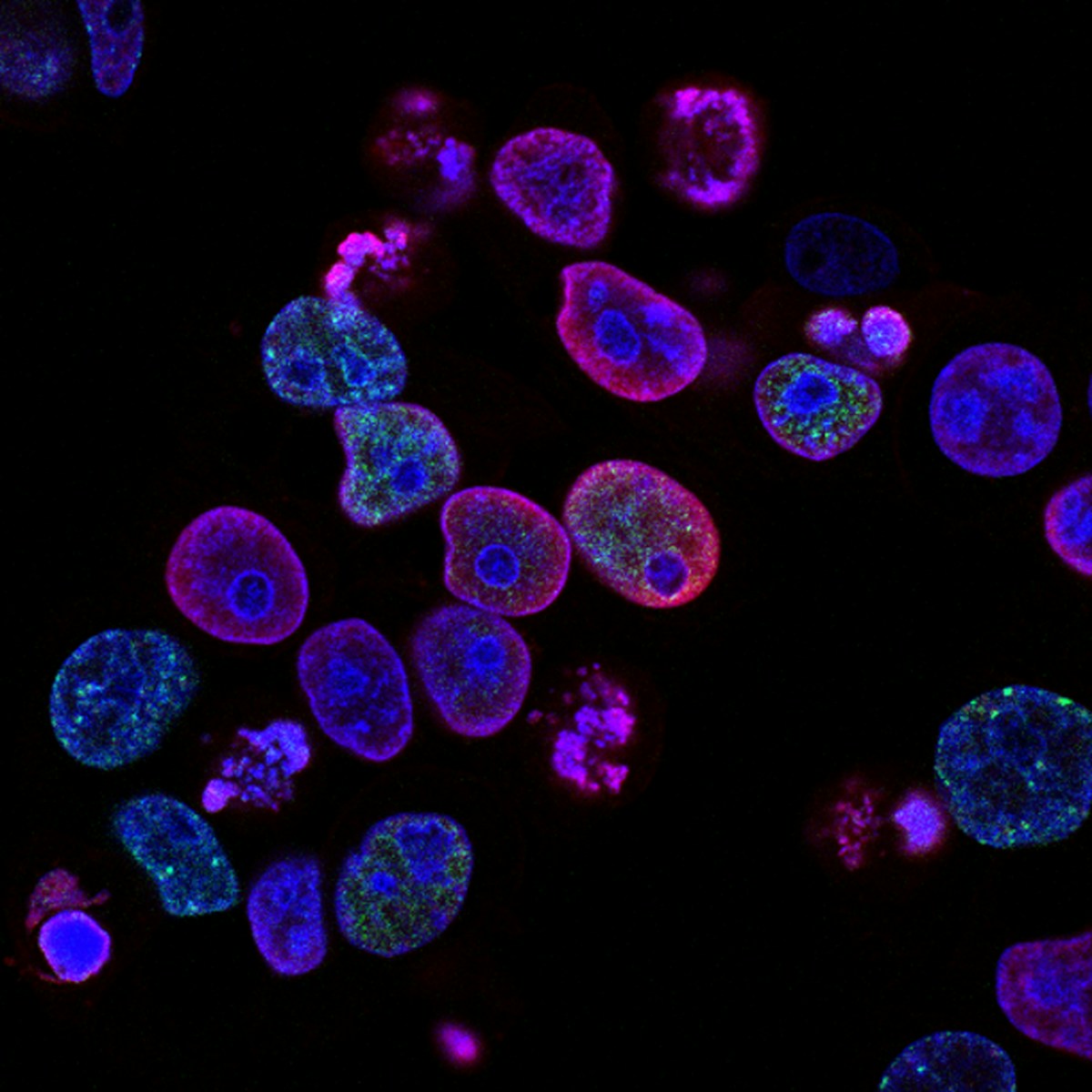
Dalla barriera emato-encefalica agli organi completi
Il prossimo passo è capire come le dimensioni e la forma dei microtubi influenzino la vascolarizzazione. Non tutti i tessuti hanno le stesse esigenze: il cervello ha bisogno della barriera emato-encefalica, una struttura altamente selettiva che protegge i neuroni da sostanze indesiderate. Ricrearla in laboratorio significa progettare microtubi con proprietà specifiche, che permettano solo a certe molecole di attraversare le pareti.
Wang è chiara sull’obiettivo finale: “Vogliamo portare la rilevanza fisiologica di questi tessuti ingegnerizzati più vicino ai nostri corpi. Se perfezioniamo questa tecnologia, possiamo assemblare non solo un singolo organo ma più organi come sistema vivente basato su cellule umane”.
L’idea non è fantascienza. Altri gruppi di ricerca stanno già stampando in 3D vasi sanguigni artificiali per chirurgia di bypass, mentre aziende come Humacyte hanno ottenuto approvazioni regolatorie per vasi acellulari bioingegnerizzati utilizzabili in trapianti vascolari d’emergenza.
Il primo utilizzo pratico potrebbe essere nel mantenere gli organi destinati ai trapianti. Con un sistema vascolare artificiale funzionante, fegati, reni e cuori potrebbero essere trasportati per tempi più lunghi tra donatori e riceventi, riducendo il numero di organi che si deteriorano durante il trasporto.
Sistema vascolare artificiale, quanto manca alla realtà clinica
Come sempre, il salto dal laboratorio al paziente non è immediato. I microtubi funzionano nei test preliminari, ma servono studi più approfonditi per capire come si comportano in condizioni fisiologiche reali. Bisogna verificare che non causino infiammazioni, che non si degradino troppo rapidamente, che si integrino con i tessuti del ricevente.
Ma il principio è solido. I microtubi distribuiscono fluidi, le cellule ricevono ossigeno, i tessuti sopravvivono. È un passo avanti concreto verso organi artificiali funzionanti, verso una medicina rigenerativa che non dipende più dalla disponibilità di donatori.

Finché i tessuti artificiali avranno bisogno di respirare, qualcuno dovrà costruire le tubature.