Settant’anni di psichiatria basata sulla serotonina e forse ci siamo persi qualcosa. Tipo tutto il resto. Un team sudcoreano ha appena dimostrato che lo stress cronico provoca depressione attraverso un meccanismo che gli antidepressivi tradizionali nemmeno sfiorano: la glicosilazione delle proteine nel cervello.
Tradotto: lo stress toglie piccole catene di zucchero dalle proteine dei neuroni, destabilizzando i circuiti emotivi. L’enzima responsabile si chiama St3gal1 e quando smette di funzionare, la depressione arriva anche se non hai vissuto traumi. È biochimica pura, pubblicata su Science Advances, e suggerisce che forse abbiamo cercato la soluzione nel posto sbagliato per decenni.
Quando lo zucchero manca, i neuroni collassano
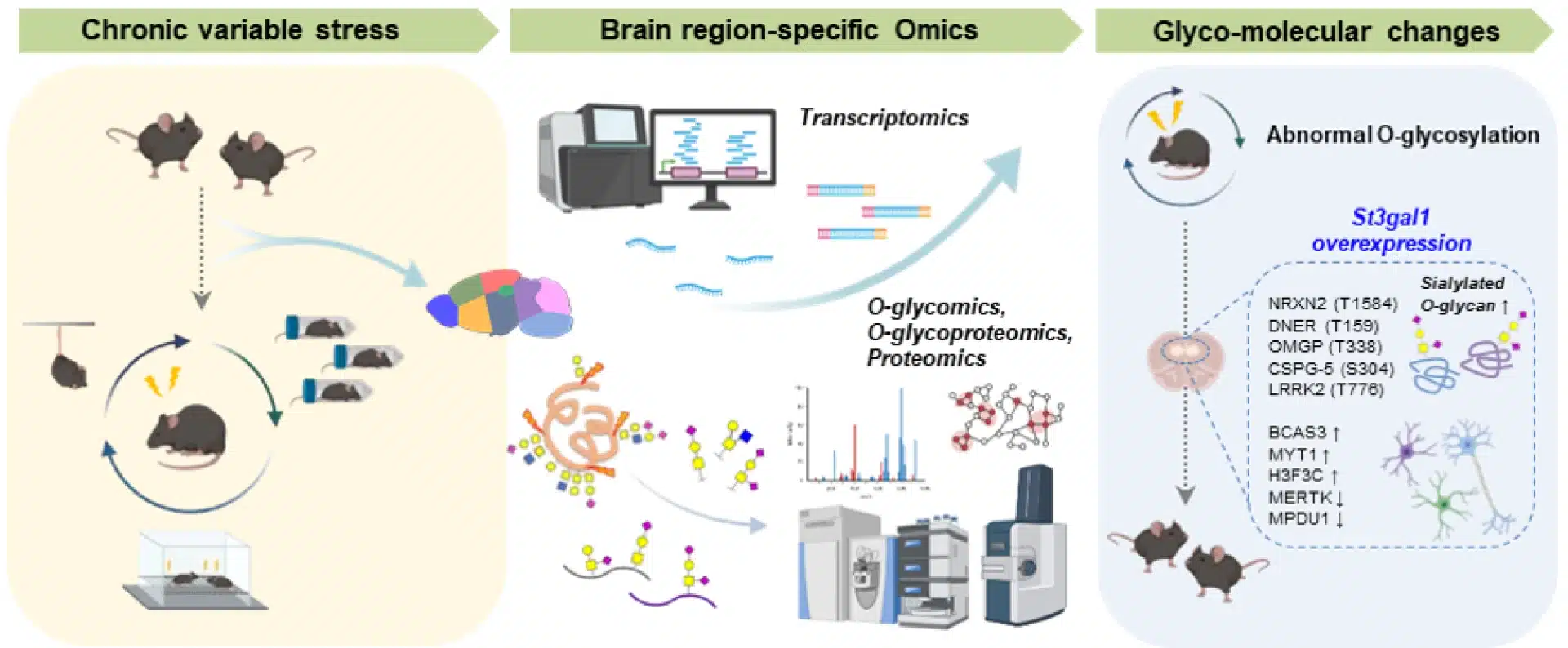
Il cervello sotto stress cronico non si limita a produrre più cortisolo o meno serotonina. Riscrive la superficie delle sue cellule nervose, modificando le decorazioni molecolari che tengono insieme i circuiti. I ricercatori dell’Institute for Basic Science in Corea del Sud hanno mappato i pattern di O-glicosilazione in nove regioni cerebrali di topi sani e stressati.
La O-glicosilazione è il processo attraverso cui catene di zucchero (glicani) vengono attaccate alle proteine dopo la loro sintesi. Serve a stabilizzare le proteine, regolare quanto durano e come interagiscono alle sinapsi.
Nei topi sottoposti a stress cronico, una regione del cervello mostrava un cambiamento netto: la corteccia prefrontale mediale, quella che regola l’umore. Qui, lo stress aveva ridotto drasticamente la sialilazione, l’ultimo passaggio della glicosilazione in cui l’acido sialico viene aggiunto come “tappo” finale alle catene di zucchero. Insieme a questo crollo, i livelli dell’enzima St3gal1 erano crollati. Senza St3gal1, le proteine sinaptiche perdevano le loro etichette molecolari e diventavano instabili.
L’esperimento che cambia le carte in tavola
A questo punto il team ha fatto quello che ogni scienziato serio farebbe: ha cercato di rompere il giocattolo per capire come funziona. Hanno manipolato geneticamente topi sani per sopprimere l’espressione di St3gal1 nella corteccia prefrontale. Risultato: gli animali hanno sviluppato sintomi depressivi anche senza essere mai stati stressati. Perdita di motivazione, ansia elevata, comportamenti di evitamento sociale. Poi hanno fatto l’opposto: hanno aumentato i livelli di St3gal1 in topi cronicamente stressati. I sintomi depressivi sono scomparsi.
Il meccanismo è elegante nella sua semplicità brutale. St3gal1 mantiene le “etichette” di zucchero su proteine come la neurexina-2, che supporta la comunicazione tra neuroni. Nei topi stressati, quelle etichette sparivano insieme alla normale trasmissione neuronale. Ripristinando St3gal1, tutto tornava. Come dice Boyoung Lee, ricercatore del team: “Questo studio dimostra che la glicosilazione anormale nel cervello è direttamente connessa all’insorgenza della depressione“.
Perché gli antidepressivi funzionano male
La maggior parte degli antidepressivi in commercio agisce sulla serotonina. Aumentano i suoi livelli o ne modificano la segnalazione. Il problema? Lo stress cronico modifica il cervello ben oltre i neurotrasmettitori. Cambia la struttura fisica delle sinapsi, riduce le connessioni tra neuroni, altera l’espressione genica. La scoperta coreana aggiunge un pezzo fondamentale: lo stress riscrive le modifiche post-traduzionali delle proteine, cioè quelle decorazioni molecolari che avvengono dopo che una proteina è stata sintetizzata.
Studi precedenti avevano già mostrato che il cortisolo cronicamente elevato riduce la neurogenesi nell’ippocampo, altera le connessioni sinaptiche e causa atrofia in alcune regioni cerebrali. Ma questi erano effetti “a valle”. La glicosilazione anormale sembra essere un meccanismo “a monte”, più vicino al punto in cui lo stress cronico inizia a fare danni. È tipo scoprire che il problema non era il motore, ma il carburante sbagliato che hai messo dentro.
Maschi e femmine, strade diverse
C’è un dettaglio curioso nello studio che apre più domande di quante ne chiuda. I topi femmina sottoposti a stress cronico mostravano cambiamenti comportamentali simili ai maschi, ma i loro livelli di St3gal1 non cambiavano affatto. Significa che maschi e femmine potrebbero usare percorsi molecolari diversi per gestire l’adversità. O forse le femmine compensano attraverso altri meccanismi di glicosilazione che lo studio non ha indagato.
Questo dato non è marginale. La depressione colpisce le donne con una frequenza doppia rispetto agli uomini, ma gli studi preclinici usano ancora prevalentemente topi maschi. Se i meccanismi sono diversi, i trattamenti dovrebbero esserlo. La ricerca suggerisce che stiamo appena iniziando a capire quanto la biologia del sesso conti nei disturbi mentali.
Stress cronico, oltre la serotonina: cosa cambia ora
La scoperta apre almeno tre strade concrete. Prima: St3gal1 potrebbe diventare un biomarcatore diagnostico. Misurare i livelli dell’enzima o i pattern di glicosilazione potrebbe aiutare a identificare chi è più vulnerabile alla depressione da stress, prima che i sintomi diventino evidenti.
Seconda: farmaci che modulano la glicosilazione potrebbero rappresentare una nuova classe di antidepressivi, completamente diversa dagli inibitori della ricaptazione della serotonina.
Terza: lo stress cronico altera anche altri sistemi di modifiche post-traduzionali, come la metilazione del DNA e la regolazione epigenetica. La glicosilazione potrebbe essere solo uno dei tanti livelli su cui lo stress riscrive il cervello. Come sottolinea C. Justin Lee, direttore dell’IBS: “Questa scoperta potrebbe estendersi non solo alla terapia della depressione, ma anche ad altri disturbi mentali come il PTSD e la schizofrenia”.
Il dato più inquietante? La depressione colpisce oltre 280 milioni di persone nel mondo nel 2025, e i trattamenti attuali rimangono limitati. Molti pazienti non rispondono agli SSRI, altri sviluppano resistenza o subiscono effetti collaterali pesanti. La ricerca coreana suggerisce che forse stiamo curando il sintomo sbagliato.
Lo stress cronico è più furbo di quanto pensavamo
C’è qualcosa di inquietante nel modo in cui lo stress cronico opera. Non ti colpisce frontalmente. Non è drammatico. Si infiltra lentamente, modificando un enzima qui, una catena di zucchero là. Altera il sistema immunitario, scatena infiammazione cronica, riduce il volume della corteccia prefrontale. E ora sappiamo che riscrive anche le decorazioni molecolari sui neuroni. È tipo un hacker che non abbatte il sistema, ma modifica il codice una riga alla volta finché tutto smette di funzionare.
La buona notizia è che questi cambiamenti potrebbero essere reversibili. Almeno nei topi, aumentare St3gal1 ha invertito i sintomi depressivi. La cattiva notizia è che gli effetti dello stress si accumulano per mesi, lasciando tracce biochimiche che durano molto più a lungo dell’evento stressante. Il cortisolo nei capelli racconta storie di ansia vissuta settimane prima. E le modifiche epigenetiche possono essere tramandate per generazioni.
Settant’anni di antidepressivi basati sulla serotonina non sono stati inutili. Hanno aiutato milioni di persone. Ma forse è ora di ammettere che la depressione non è un problema semplice con una soluzione semplice. È un collasso sistemico che inizia a livello molecolare, ben prima che tu ti accorga di non avere più voglia di uscire dal letto.
Lo stress cronico non ti cambia l’umore. Ti riscrive il cervello, una proteina alla volta. E ora, finalmente, stiamo iniziando a capire come.


