Nel cancro al seno triplo negativo, circa il 5% delle cellule del tumore primario ha una caratteristica particolare: è altamente predisposto a metastatizzare. Queste cellule condividono un tratto distintivo: livelli elevati di EZH2, un enzima che normalmente regola l’impacchettamento del DNA. Ma nei tumori, EZH2 viene sovra-prodotto e inizia a silenziare geni chiave per la corretta divisione cellulare.
I ricercatori della Weill Cornell Medicine hanno scoperto che questo silenziamento innesca una catena di eventi molecolari che porta alla moltiplicazione incontrollata dei centrosomi e all’instabilità cromosomica, condizioni perfette perché le cellule tumorali si diffondano in organi distanti.
EZH2, come un enzima epigenetico scatena il caos
EZH2 è una specie di “interruttore molecolare” che fa parte di un gruppo di proteine chiamato complesso PRC2. Il suo compito è attaccare piccoli “segnali chimici” (gruppi metile) a una proteina chiamata istone H3, attorno alla quale il DNA è avvolto come su una bobina. Quando EZH2 mette questi segnali in un punto preciso (la lisina 27), il tratto di DNA che sta lì vicino viene spento: il gene non lavora più, anche se la sequenza del DNA rimane identica. In pratica, EZH2 non cambia il DNA, ma lo rende temporaneamente inaccessibile.
Il problema nasce quando EZH2 va in sovraccarico. Studi pubblicati sul Journal of Hematology & Oncology dimostrano che l’enzima è sovraespresso in diversi tumori, dal melanoma al cancro al polmone, dalla vescica all’endometrio. Ma è nel triplo negativo che il suo ruolo diventa particolarmente insidioso.
Lo studio condotto dal team di Vivek Mittal alla Weill Cornell Medicine, pubblicato su Cancer Discovery, ha analizzato i dati di pazienti con cancro al seno e trovato una correlazione diretta: chi aveva livelli più alti di EZH2 mostrava anche più alterazioni cromosomiche nelle cellule tumorali. Un segnale che qualcosa, a livello molecolare, stava andando storto.
La cascata molecolare che porta alle metastasi
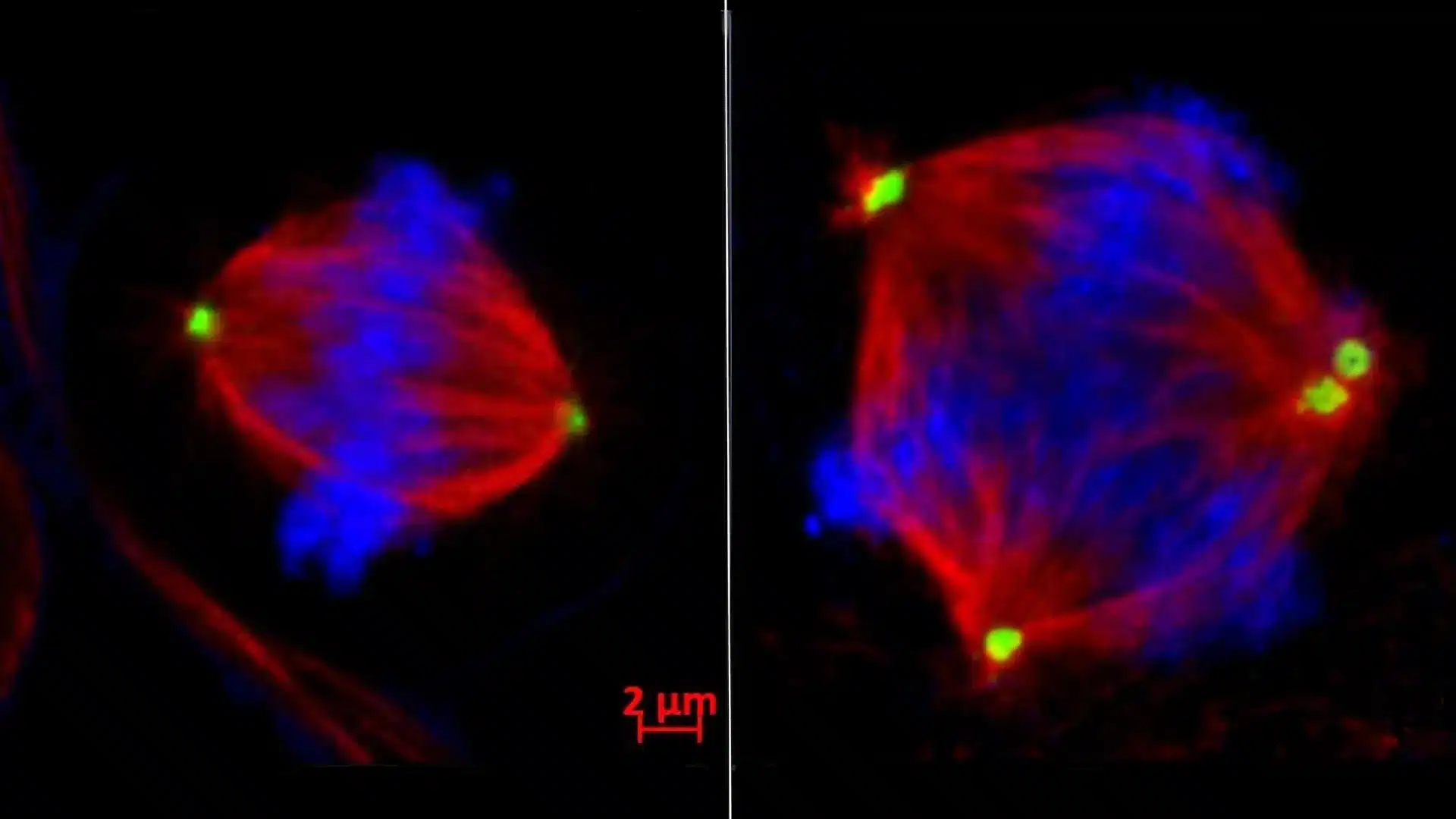
I ricercatori hanno ricostruito il meccanismo passo dopo passo. Quando EZH2 viene prodotto in eccesso, silenzia il gene tankyrase 1, che normalmente garantisce che i centrosomi (le strutture che separano i cromosomi durante la divisione cellulare) funzionino correttamente. Senza tankyrase 1, un’altra proteina chiamata CPAP inizia ad accumularsi. E quando CPAP raggiunge livelli troppo alti, i centrosomi si moltiplicano senza controllo.
Invece di due centrosomi per cellula, ne compaiono tre, quattro, cinque. Il risultato è una divisione cellulare difettosa: invece di generare due cellule figlie identiche, la cellula madre produce tre o più cellule con cromosomi distribuiti in modo casuale. Alcune ricevono troppi cromosomi, altre troppo pochi. È instabilità cromosomica. Ed è esattamente quello che serve a un tumore per adattarsi, resistere ai farmaci e migrare.
I farmaci che bloccano EZH2 esistono già
La buona notizia è che inibire EZH2 è possibile. Il tazemetostat, un farmaco approvato dalla FDA per il linfoma follicolare e il sarcoma epitelioide, blocca specificamente l’attività enzimatica di EZH2. Studi clinici recenti, tra cui uno pubblicato a gennaio 2025, hanno testato combinazioni di tazemetostat con l’immunoterapia pembrolizumab in pazienti con tumori testa-collo, dimostrando tollerabilità e sicurezza.
Nei modelli murini di cancro al seno triplo negativo, il blocco di EZH2 ha ridotto significativamente le metastasi polmonari. Le cellule tumorali, private del loro meccanismo di instabilità cromosomica, perdevano la capacità di adattarsi e migrare. Secondo l’AIRC, gli inibitori di EZH2 rappresentano una delle frontiere più promettenti della terapia epigenetica contro il cancro.
Il triplo negativo colpisce circa 8.000 donne all’anno in Italia, rappresentando il 15% di tutti i tumori al seno. È una delle forme più aggressive: mancano i recettori per estrogeni, progesterone e HER2, quindi le terapie ormonali e i farmaci mirati anti-HER2 non funzionano. Secondo la Fondazione Veronesi, l’immunoterapia combinata alla chemioterapia ha portato la sopravvivenza a 5 anni all’86% nelle forme precoci. Ma per le metastatiche servono ancora nuove strategie.
Perché bloccare il caos funziona meglio che aumentarlo
C’è un dibattito in oncologia: conviene spingere l’instabilità cromosomica oltre il limite, fino a far collassare le cellule tumorali? O è meglio ripristinare l’ordine? Vivek Mittal è chiaro:
“Trovare il livello giusto di caos per uccidere le cellule è complicato. Se non ci arrivi, rischi di rendere il tumore più aggressivo. Ripristinare l’ordine bloccando EZH2 è più sicuro e più efficace.”
I trial clinici per testare gli inibitori di EZH2 nel triplo negativo sono già in programma. L’obiettivo è somministrare il farmaco alle pazienti ad alto rischio di metastasi, quelle con livelli elevati di EZH2 nel tumore primario, per bloccare la diffusione prima ancora che inizi.

Un enzima epigenetico, un gene silenziato, una proteina che si accumula, centrosomi che si moltiplicano, cromosomi distribuiti a caso. E alla fine, metastasi. La catena è lunga, ma l’interruttore è uno solo. Bloccarlo potrebbe cambiare la storia del cancro al seno triplo negativo.
I farmaci ci sono. Ora servono i trial per dimostrare che funzionano anche nelle pazienti.