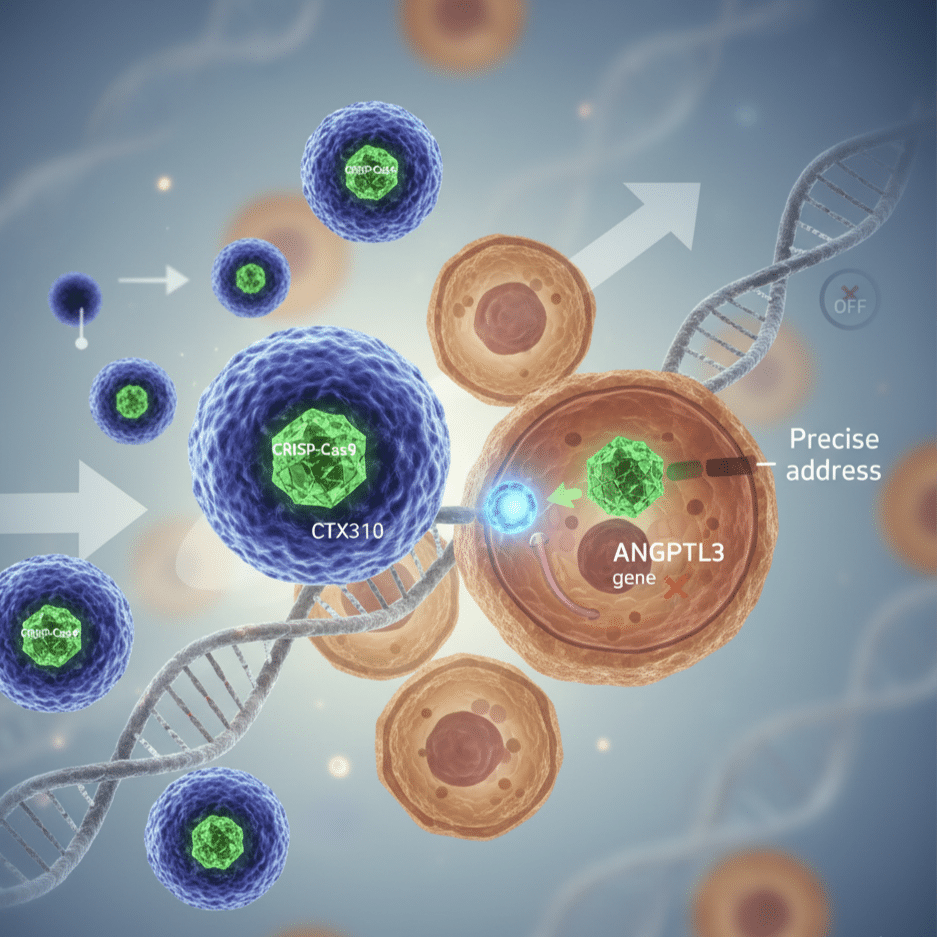
Una flebo: nanoparticelle che viaggiano nel sangue, raggiungono il fegato, entrano nelle cellule. Dentro c’è un RNA guida che conosce l’indirizzo (il gene ANGPTL3) e poi c’è Cas9, la proteina che taglia il DNA. Zac: il gene smette di produrre la sua proteina. Il colesterolo si cura e scende. Per sempre, sperano. O almeno finché non sapremo di più su cosa succede quando disattivi un gene in un essere umano adulto e lo lasci girare per il mondo con quel DNA modificato.
La Cleveland Clinic ha testato questo preparato, chiamato CTX310, su 15 pazienti tra giugno 2024 e agosto 2025. Colesterolo LDL: -49%. Trigliceridi: -55%. Lo studio è stato pubblicato ieri sul New England Journal of Medicine. La fase 2 è prevista per fine 2025.
Il gene che la natura ha già spento
Partiamo dal contesto: circa una persona su 250 nasce con il gene ANGPTL3 non funzionante. Nessuna conseguenza negativa apparente, ma il colesterolo LDL si mantiene basso per tutta la vita, i trigliceridi sono sempre sotto controllo e il rischio cardiovascolare è ridotto dell’88% secondo uno studio del 2006 sul NEJM.
ANGPTL3 normalmente inibisce gli enzimi che scompongono i grassi nel sangue. In sua assenza, il fegato continua a rimuovere il colesterolo in eccesso senza ostacoli. È tipo un difetto di fabbrica che migliora il prodotto.
L’idea dietro CTX310 è semplice: replicare quella mutazione naturale in persone che non ce l’hanno. CRISPR Therapeutics ha sviluppato nanoparticelle lipidiche che trasportano l’editor genetico CRISPR-Cas9 direttamente nel fegato. Una volta dentro le cellule epatiche, il sistema taglia il DNA di ANGPTL3 in punti specifici. La cellula prova a riparare il danno, ma il gene rimane disattivato. Permanentemente.
Il trial ha coinvolto 15 adulti tra 31 e 68 anni, tutti con colesterolo e trigliceridi alti resistenti ai farmaci tradizionali. Cinque dosi diverse di CTX310, da 0,1 a 0,8 mg per chilo di peso corporeo. Prima dell’infusione: corticosteroidi e antistaminici per prevenire reazioni. Poi quattro ore e mezza di flebo.
Risultato alla dose più alta: ANGPTL3 ridotta del 73% (massimo 89%), colesterolo LDL -49% (massimo 87%), trigliceridi -55% (massimo 84%).
Dati alla mani, tutto quello che è successo
Tre pazienti hanno avuto reazioni lievi durante l’infusione: mal di schiena, nausea. L’infusione è stata messa in pausa, somministrati antiemetici, ripresa. Tutti hanno completato il trattamento. Un paziente ha sviluppato un’eruzione cutanea il giorno dopo, risolta in 24 ore. Un altro paziente aveva enzimi epatici elevati già prima del trattamento: sono aumentati ancora per qualche giorno (tra 3 e 5 volte il valore base), poi sono tornati normali entro due settimane senza alcun intervento.
E poi c’è il caso che conta. Un paziente è morto 179 giorni dopo l’infusione. Aveva ricevuto la dose più bassa, 0,1 mg/kg, praticamente inefficace. Aveva una malattia cardiovascolare avanzata preesistente. Gli investigatori hanno concluso che la morte non è correlata al trattamento. Ma quando modifichi il DNA di esseri umani vivi, ogni evento conta. Anche se statisticamente irrilevante, anche se clinicamente non correlato.
Cosa manca ancora
Quindici persone. Sessanta giorni di follow-up. Prevalentemente uomini (87%). Tutti bianchi o asiatici. Nessun dato sulla durata reale dell’effetto oltre i due mesi. Nessuna informazione sulle mutazioni off-target, i tagli indesiderati del DNA in altri punti del genoma. Il protocollo prevede 15 anni di monitoraggio, come richiede l’FDA per tutte le terapie basate su CRISPR.
Kiran Musunuru, ricercatore della Penn Medicine coinvolto in studi su CRISPR, ha dichiarato durante la conferenza stampa che ANGPTL3 è un “bersaglio molto attraente” proprio perché le persone con mutazioni naturali non mostrano problemi.
Ma ha anche ricordato cosa è successo a Intellia Therapeutics: un paziente è morto per grave danno epatico poche settimane dopo il trattamento CRISPR per amiloidosi da transtiretina. Gene diverso, popolazione diversa, ma la domanda resta: quanto è sicuro editare il DNA di persone con malattie croniche ma non mortali?
Il confronto con quello che esiste
Le statine costano poco e funzionano per molti. Gli anticorpi monoclonali anti-PCSK9 riducono il colesterolo LDL del 50-60% ma richiedono iniezioni ogni due settimane o un mese. Per tutta la vita. Inclisiran, una terapia a RNA interferente, abbassa il colesterolo con due iniezioni l’anno. CTX310 promette una sola infusione. E poi più nulla.
Il problema sicuro già oggi? È il prezzo. Casgevy, la prima terapia CRISPR approvata (per anemia falciforme e beta-talassemia), costa 2,2 milioni di dollari a paziente. CTX310 sarà probabilmente nella stessa fascia. Per un’ipercolesterolemia familiare che oggi si gestisce con farmaci da poche centinaia di euro l’anno, il calcolo costo-beneficio diventa complicato. Soprattutto quando i dati di sicurezza a lungo termine non ci sono ancora.
Il mercato potenziale è enorme. Decine di milioni di persone (40 milioni solo negli USA) hanno trigliceridi o colesterolo LDL elevati. CRISPR Therapeutics sta già lavorando su altri due programmi cardiovascolari: CTX320 per la lipoproteina(a) e CTX340 per l’ipertensione. L’idea è costruire un’intera linea di terapie genetiche per le malattie del cuore.
Cura CRISP per il colesterolo: quando arriverà (forse)
Steven Nissen, cardiologo della Cleveland Clinic e senior author dello studio, ha dichiarato che la Fase 2 inizierà “presto, molto presto”, seguita rapidamente dalla Fase 3. L’obiettivo è completare tutto entro la fine del 2026.
“Ci stiamo muovendo molto velocemente perché questo è un bisogno medico enorme”, ha aggiunto.
Il problema è che “molto velocemente” nel mondo delle terapie geniche significa comunque anni. La Fase 3 dovrà coinvolgere migliaia di pazienti per dimostrare efficacia e soprattutto sicurezza su popolazioni più ampie e diverse. I regolatori vorranno dati a lungo termine. I pazienti con ipercolesterolemia familiare grave potrebbero non avere anni da aspettare, ma quelli con colesterolo moderatamente alto potrebbero non voler essere tra i primi a provare.
La domanda che resta
Modificare il DNA di una persona adulta per prevenire malattie future è diverso da curare un bambino con anemia falciforme mortale. La soglia rischio-beneficio si sposta.
Un’infusione che potrebbe eliminare le statine per sempre, una cura finale per il colesterolo suona bene. Ma “per sempre” significa anche che non puoi più tornare indietro, bisogna andarci cauti. Il gene ANGPTL3 rimarrà spento per il resto della vita del paziente. E se tra dieci anni scopriamo che quella proteina serviva anche per qualcos’altro?
Le persone con la mutazione naturale stanno bene, è vero. Ma sono nate così. Il loro organismo si è sviluppato compensando da sempre. Spegnere lo stesso gene a 50 anni, in un corpo che ha funzionato diversamente per mezzo secolo, potrebbe non essere esattamente la stessa cosa. I test sui topi sembravano promettenti già nel 2021. Ora abbiamo i primi dati umani. Tra qualche anno avremo le risposte vere.
Intanto, CTX310 avanza. La Fase 2 partirà entro fine anno. I cardiologi iniziano a parlare di “editing genetico preventivo” come fosse una categoria farmacologica normale. E forse lo diventerà. O forse scopriremo che alcune cose è meglio lasciarle come la natura le ha fatte, anche quando la natura fa errori.


