Una goccia di sangue cade sul vetrino con quel tonfo sordo, microscopico, che solo chi passa la vita in laboratorio sa riconoscere. Poi, inizia l’attesa. Per noi umani è come guardare la vernice che asciuga: noia pura, l’equivalente visivo di un pomeriggio in sala d’aspetto. Per l’algoritmo sviluppato all’Università di Tokyo, invece, è un film d’azione. Ammazza, quanto sono evocativo oggi. Mentre l’acqua evapora, la goccia di sangue si muove, si spacca, crea schemi che sembrano mappe geografiche di un continente alieno in rapida desertificazione. Lì, tra una crepa e un grumo, c’è scritto se hai il diabete o la malaria. Non serve un ematologo con vent’anni di esperienza per leggerlo, basta una telecamera da pochi soldi e un’intelligenza artificiale che non batte ciglio. È grezzo, è semplice, ed è dannatamente brillante.
Il fantasma di Elizabeth Holmes
Diciamocelo subito, togliamoci il dente. Quando sentiamo “diagnosi con una goccia di sangue”, il pensiero corre subito a lei: Elizabeth Holmes. Collo alto nero, voce impostata, e quella scatoletta magica, “Edison”, che prometteva di fare centinaia di analisi con un prelievo capillare. Sappiamo come è finita: ne abbiamo parlato anche qui. Miliardi bruciati, pazienti a rischio, e una condanna a 11 anni di carcere per frode. Theranos ha avvelenato il pozzo. Ha reso l’idea stessa di “micro-prelievo” sinonimo di truffa, o quantomeno di illusione tecnologica.
Ma poi succede. Succede che mentre il mondo guarda altrove, scottato dalla Silicon Valley, la scienza vera (quella noiosa, che non fa keynote con le luci stroboscopiche, quella che i commentatori distratti di Facebook considerano sempre ferma) continua a lavorare. E scopre che il problema di Theranos non era l’ambizione, ma il metodo. Cercavano di miniaturizzare un laboratorio chimico, stipando centrifughe e reagenti in una scatola da scarpe. Un incubo ingegneristico.
Il team giapponese guidato da Miho Yanagisawa e Anusuya Pal ha fatto l’opposto. Ha buttato via la chimica complessa e ha guardato la fisica. Hanno chiesto: “Cosa succede se lasciamo fare alla natura?”.
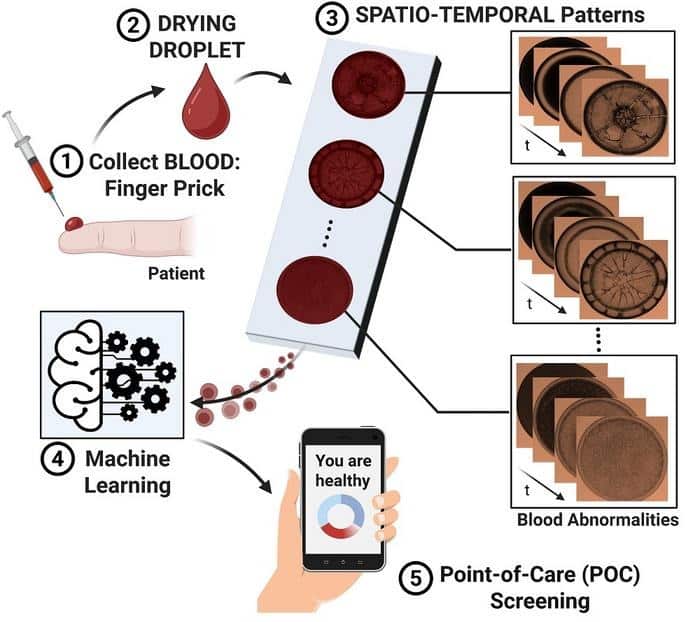
Leggere i fondi di caffè (ma col sangue)
Il principio è, paradossalmente, simile alla lettura dei fondi di caffè, solo che qui c’è rigorosa idrodinamica. Quando una goccia di un fluido biologico (una goccia di sangue, ma anche urina o saliva) si asciuga, non lo fa a caso. I componenti solidi (globuli rossi, proteine, zuccheri) vengono trascinati dai movimenti del liquido che evapora. Si scontrano, si aggregano, si depositano.
In una persona sana, questo balletto microscopico segue un ritmo preciso. Le crepe si formano in un certo modo, i bordi si ispessiscono secondo regole fisse. Ma se c’è un’anomalia? Se c’è troppo glucosio (diabete) o se i globuli rossi sono parassitati (malaria)?
In quel caso, il ballo cambia. Le crepe si fanno caotiche, o spariscono. I bordi si frastagliano diversamente. È un linguaggio visivo complesso che nessun occhio umano potrebbe decifrare in tempo reale. Ma un’intelligenza artificiale? Per lei è come leggere l’alfabeto. Lo studio, pubblicato su Advanced Intelligent Systems, dimostra che analizzando il video dell’asciugatura (non solo l’immagine finale), l’AI raggiunge una precisione diagnostica impressionante.
Il dettaglio tecnico: La chiave non è il “dove” finiscono le particelle, ma il “come” ci arrivano. L’algoritmo non guarda la foto ricordo, guarda il film per intero. È la dinamica temporale dell’evaporazione (il drying process) a contenere i dati vitali.
La rivincita del low-tech
La vera ironia è che questa tecnologia sembra uscita dal garage di un maker, non da un laboratorio sterile da miliardi di dollari. Cosa serve? Un microscopio ottico standard, una fotocamera digitale (o uno smartphone decente) e un computer portatile. Nessun reagente chimico costoso che scade dopo una settimana. Nessun macchinario proprietario che si rompe se lo guardi storto (sì, stiamo guardando ancora te, “Edison”).
È “lato B” dell’innovazione moderna: a volte per andare avanti devi semplificare, non complicare. Questo approccio, che gli autori definiscono “Drying Droplet”, potrebbe portare la diagnostica avanzata in villaggi rurali dell’Africa o in cliniche isolate dell’Asia, dove oggi un esame del sangue completo è un lusso logistico.
Non serve trasportare il sangue in un centro analisi refrigerato. Lo metti sul vetrino, lo guardi asciugare, l’AI ti dice “probabile malaria”. Fine. Un po’ come avere un laboratorio intero in tasca, ma senza il marketing aggressivo della Silicon Valley.

Una goccia di sangue e nessuna magia: solo fisica
C’è un limite, ovviamente. Non stiamo parlando di sostituire domani mattina ogni analisi ospedaliera. Questo sistema è uno strumento di screening, un primo baluardo rapido ed economico. Ma segna un punto fondamentale: la complessità non è sempre sinonimo di precisione. A volte, i segnali più chiari sono quelli che abbiamo sempre ignorato perché sembravano troppo banali. Chi si metteva a studiare le crepe nel fango secco?
E qui torniamo al punto di partenza. Elizabeth Holmes voleva vendere una magia nera tecnologica, una scatola chiusa che faceva tutto. Yanagisawa e Pal ci offrono fisica trasparente. Si vede tutto. Si vede la goccia di sangue, si vede l’acqua che va via, si vede il risultato.
La vera morale di questa storia non è medica, ma culturale. Abbiamo smesso di credere ai miracoli delle startup unicorno e abbiamo ricominciato a guardare come funziona il mondo reale. Una goccia alla volta. Meglio una diagnosi vera basata su una macchia secca, che una rivoluzione immaginaria basata sul nulla.


