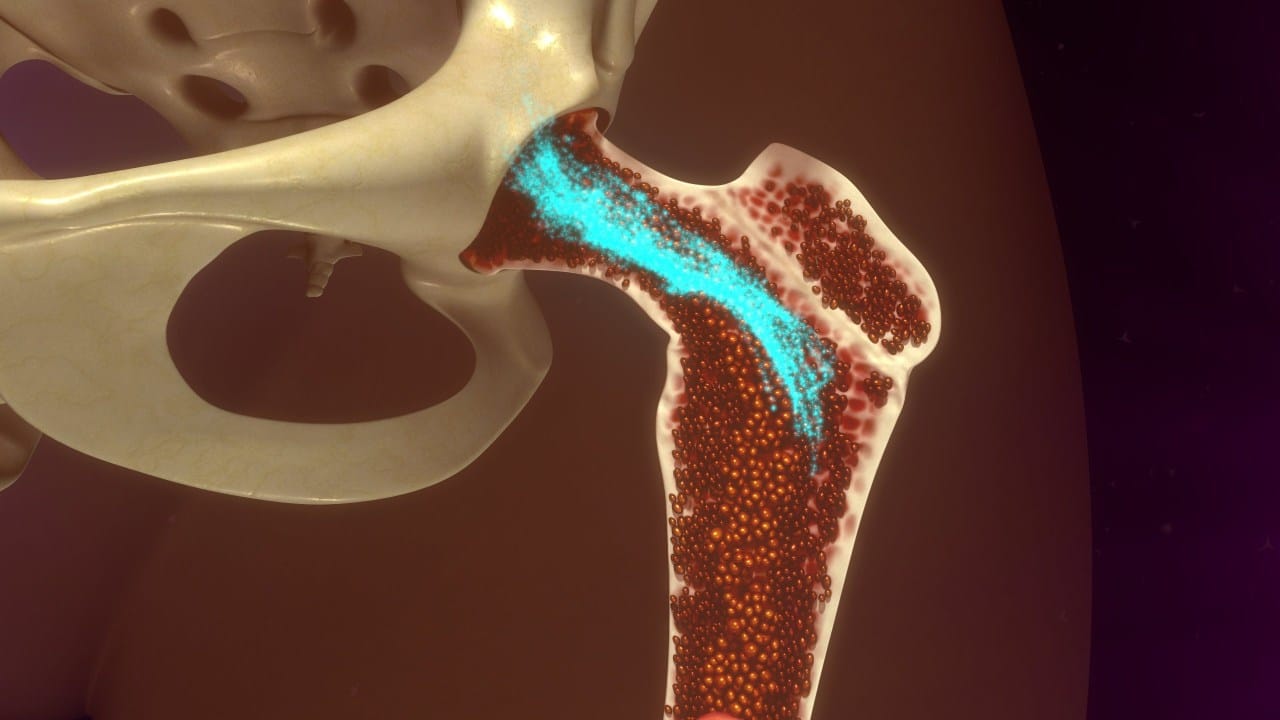
In un laboratorio dell’Università di Basilea, qualcosa di straordinario sta crescendo dentro una struttura di appena otto millimetri. Non è un organo vero. Non è neanche un tessuto naturale. Eppure produce sangue, esattamente come farebbe il midollo osseo nel vostro corpo in questo preciso istante.
Stiamo assistendo a una prima assoluta nella bioingegneria: la creazione di un modello di midollo osseo costruito interamente da cellule umane, pubblicato sulla rivista Cell Stem Cell. Non è solo un traguardo tecnico. È un passaggio che potrebbe ridefinire come studiamo le malattie del sangue e come testiamo nuove terapie contro la leucemia.
Dove eravamo: i limiti della ricerca tradizionale
Fino a oggi, capire come funziona il midollo osseo significava fare una scelta difficile. Da una parte, i modelli animali: topi di laboratorio che ci hanno insegnato moltissimo ma che restano, appunto, topi. La loro biologia ematopoietica differisce dalla nostra in modi che contano, soprattutto quando si tratta di testare farmaci che dovranno poi funzionare su esseri umani.
Dall’altra parte, le colture cellulari in laboratorio: semplici, controllabili, ma terribilmente semplificate. Come spiega il Professor Ivan Martin, co-autore dello studio, queste colture non riescono a riprodurre la complessità architettonica del midollo reale, quella rete intricata di cellule ossee, vasi sanguigni, nervi e cellule immunitarie che lavorano insieme.
Il midollo osseo non è un tessuto uniforme. È un mosaico di microambienti specializzati, chiamati “nicchie”. Una di queste, la nicchia endosteale, è particolarmente importante perché si trova vicino alla superficie dell’osso ed è cruciale sia per la formazione del sangue che per la resistenza ai trattamenti nei tumori del sangue. Fino ad ora, nessun modello umano includeva tutti questi componenti cellulari.
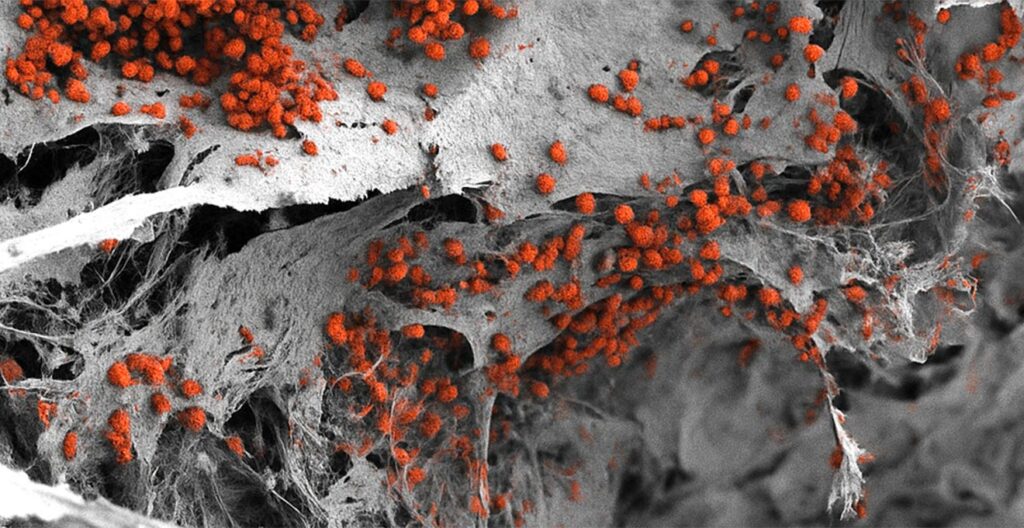
Midollo osseo, dove siamo: costruire una fabbrica biologica
La costruzione di questo modello di midollo osseo parte da un’impalcatura artificiale fatta di idrossiapatite, lo stesso minerale che rende dure ossa e denti. Ma l’innovazione vera sta in quello che i ricercatori svizzeri ci hanno fatto crescere sopra.
Hanno utilizzato cellule umane riprogrammate in cellule staminali pluripotenti, quelle cellule straordinariamente versatili che possono trasformarsi in qualsiasi tipo cellulare a seconda dei segnali chimici che ricevono. Integrando queste cellule nella struttura ossea artificiale, il team è riuscito a guidarle attraverso processi di differenziazione specifici per produrre l’intera gamma di tipi cellulari presenti nel midollo naturale.
Il risultato è un sistema tridimensionale di otto millimetri di diametro e quattro di spessore, più grande dei sistemi precedenti. Ma la dimensione conta meno della funzione: questo modello mantiene attiva la formazione di sangue umano in laboratorio per settimane, ricreando quella che è essenzialmente una versione miniaturizzata ma funzionante della nostra “fabbrica del sangue”.
Midollo osseo, la strada verso applicazioni concrete
La capacità di replicare la complessità del midollo osseo umano apre scenari che fino a poco tempo fa sembravano impossibili. Il primo riguarda la ricerca sul cancro del sangue. La leucemia, il tumore del sangue più comune nei bambini e negli adolescenti, colpisce direttamente il midollo osseo. Circa 3.500-4.000 nuovi casi vengono diagnosticati ogni anno solo negli Stati Uniti.
Testare nuovi farmaci contro queste patologie richiederebbe idealmente un sistema che riproduca fedelmente come le cellule tumorali interagiscono con l’ambiente del midollo. Ora ce l’abbiamo. Recenti studi hanno già dimostrato come modelli bioingegnerizzati simili possano valutare l’efficacia di terapie CAR-T per la leucemia mieloide acuta, rilevando effetti collaterali che i metodi tradizionali non avevano previsto.
Ma c’è un aspetto ancora più affascinante: la medicina personalizzata. In futuro, questo modello potrebbe essere generato dalle cellule del singolo paziente. Immaginate di poter testare quale farmaco funziona meglio su una replica del vostro midollo osseo, prima ancora di iniziare il trattamento. Non più terapie per tentativi, ma interventi calibrati sulla vostra biologia specifica.
Gli ostacoli da superare
Come sottolinea il Dr. Andrés García García, co-autore dello studio, per utilizzare questo sistema nel testing farmacologico su larga scala sarà necessario ridurne le dimensioni. Otto millimetri sono perfetti per studiare processi biologici, ma per testare simultaneamente decine di composti e dosaggi diversi serve qualcosa di ancora più compatto e standardizzabile.
C’è poi la questione della scalabilità. Produrre questi modelli richiede tempo, competenze specifiche e risorse. Prima che diventino uno strumento di routine nei laboratori di tutto il mondo, servirà ottimizzare i protocolli, automatizzare i processi, rendere la tecnologia accessibile anche a centri di ricerca con budget limitati.
E infine c’è il dibattito sempre aperto sui modelli alternativi agli animali. Sì, questo approccio promette di ridurre la dipendenza dalla sperimentazione animale. Ma sostituirla completamente? Per ora è prematuro dirlo. I modelli in vitro, per quanto sofisticati, non possono ancora replicare la complessità sistemica di un organismo intero con tutti i suoi feedback biologici.
Cosa portiamo con noi
Quello che è stato costruito a Basilea non è solo un modello di midollo osseo. È la dimostrazione che possiamo ricreare in laboratorio sistemi biologici complessi partendo da cellule umane riprogrammate. È la prova che la bioingegneria può colmare il divario tra la semplicità artificiale delle colture cellulari e la complessità irriducibile del corpo umano.
Tra dieci anni, forse, andremo dal medico e ci verranno prelevate poche cellule. In laboratorio quelle cellule diventeranno un avatar biologico del nostro midollo osseo, su cui testare terapie su misura. Tra vent’anni, magari, questa tecnologia contribuirà a trasformare la leucemia da malattia devastante a condizione gestibile, grazie a farmaci progettati testando migliaia di molecole su modelli di midollo osseo bioingegnerizzati.
Per ora, però, abbiamo raggiunto un traguardo che sembrava impossibile: abbiamo insegnato a cellule umane riprogrammate a organizzarsi in una fabbrica del sangue funzionante, in una struttura che sta nel palmo di una mano. E questo, da solo, è già straordinario.