Le cellule ondeggiano. Sempre. La membrana che le avvolge si piega, si torce, non sta mai ferma. E poi proteine che cambiano forma, molecole di ATP, adenosina trifosfato (la molecola universale che trasporta energia nelle cellule) che si spezzano per liberare energia, insomma: tutto spinge e tira sulla superficie cellulare.
Fino a ieri questi movimenti sembravano solo rumore di fondo, agitazione termica senza conseguenze. Ora un gruppo di ricercatori dell’Università di Houston e della Rutgers University ha dimostrato che quei micro-tremori generano corrente elettrica.
Il meccanismo si chiama flessoelettricità: quando un materiale si piega, le cariche al suo interno si spostano e creano tensione. Funziona con molti materiali, ma nelle membrane cellulari succede qualcosa di diverso. Le cellule non sono mai in equilibrio. Bruciano ATP, le proteine lavorano, l’energia circola. E quando l’attività biologica piega la membrana, la tensione non si annulla. Si accumula.
Novanta millivolt senza canali ionici
I calcoli del team guidato da Pradeep Sharma indicano che le fluttuazioni attive delle membrane cellulari possono produrre differenze di potenziale fino a 90 millivolt. Per capirci: è quanto serve a un neurone per attivarsi. E tutto questo avviene senza aprire un solo canale ionico, senza pompe molecolari, solo piegando la membrana al ritmo giusto.
Il dettaglio interessante è il tempo. La tensione non sale gradualmente, ma accelera. La curva ha un profilo non lineare che richiama le funzioni di attivazione usate nelle reti neurali artificiali.
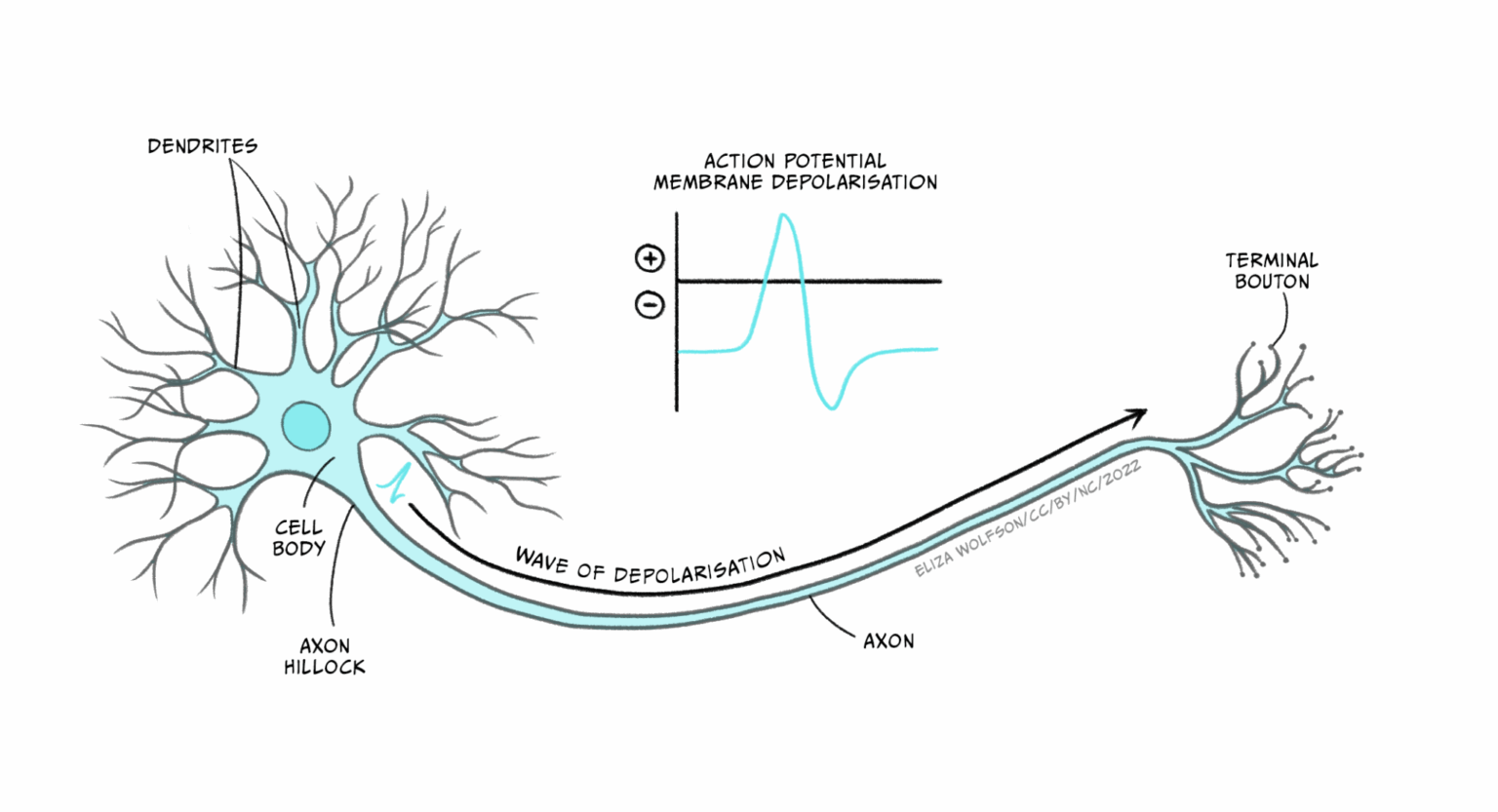
Pompare ioni con il movimento
Ma c’è dell’altro. Se la membrana genera tensione piegandosi, può anche spostare ioni contro il gradiente elettrochimico. In altre parole: fa da pompa. Senza proteine specializzate, senza consumare ATP direttamente. Basta che la polarizzazione della membrana cambi nel modo giusto, e gli ioni si muovono dove serve.
Il meccanismo era stato ipotizzato negli anni ’70, ma restava una speculazione. Adesso poggia su un modello matematico che integra meccanica statistica, fluttuazioni attive e accoppiamento elettromeccanico. Il team ha dovuto approssimare, certo, ma i conti tornano.
Scheda dello Studio
- Enti di ricerca: University of Houston, Rutgers University
- Ricercatori principali: Khandagale, Liu, Sharma
- Anno pubblicazione: 2025
- Rivista: PNAS Nexus
- DOI: 10.1093/pnasnexus/pgaf362
- TRL: 2 – Modello teorico validato matematicamente, richiede verifica sperimentale
Cosa manca
Tutto questo è teoria. Elegante, coerente, ma teoria. Misurare le tensioni da flessoelettricità in cellule vive sarà complicato. Troppi altri processi elettrici in corso, troppo rumore. Serviranno strumenti più precisi e protocolli che isolino il contributo meccanico da quello biochimico.
Se funziona davvero, però, cambia parecchie cose. Non solo per capire come i neuroni si attivano o come funziona, ad esempio, l’udito. Anche per progettare materiali che imitino questo comportamento: superfici che convertono vibrazioni in corrente, interfacce cervello-macchina più efficienti, biosensori che leggono segnali meccanici.
Per ora, resta il fatto che le membrane cellulari potrebbero fare qualcosa che non sapevamo: produrre elettricità semplicemente muovendosi. E che ogni piccolo ondeggiamento, forse, conta tanto.
Approfondisci
Ti interessa come la biologia genera energia? Leggi anche come le cellule possono nutrirsi di elettricità. Oppure scopri come i biofotoni rivelano processi elettromagnetici nelle piante.